





Eksperimenter med udgangspunkt i |
E1 - Undersøg Jordens strålingsbalance og drivhuseffekten Materialer: Gennemsigtigt kar (fx plastakvarium), kraftig lampe (500 W), lavt gennemsigtigt kar/fad, elektronisk termometer gerne med dataopsamling, sort karton. CO2(g) evt. produceret ved eddike og bagepulver. Forsøgsopstilling:
Termometeret lægges på en lille beholder i midten, så temperatursensoren ikke rører beholderen. Eksperiment 1a – Referenceeksperimentet UDF&Oslahs;RELSE: Ved hjælp af dataopsamling måles temperaturen som funktion af tiden inde i kammeret som beskrevet ovenfor. Bemærk: der skal måles min. 20 min! Reference eksperimentet skal laves hver gang opstillingen har været pakket sammen eller ændret. Hvorfor? OPGAVE: Lav en kurve over temperaturen som funktion af tiden. Beskriv kurven. Hvorfor opstår der en ligevægtstemperatur? EKSTRAOPGAVE: Beskriv i termer, du kender fra nv-undervisningen, hvorfor det er nødvendigt at lave et såkaldt referenceeksperiment (kontrolforsøg) – læs evt. om "control experiment" på Wikipedia.org. Eksperiment 1b – CO2-eksperimentet TEORI: Læs om Jordens strålingsbalance. Findes beskrevet i diverse naturgeografibøger EKSPERIMENT: Undersøg om temperaturen stiger når der tilføres ekstra CO2. HINT: Man kan producere CO2 inde i “kammeret” ved at blande eddikesyre og bagepulver. OPGAVE: Tag et billede af forsøget og indtegn strålingsbalancen. Eksperiment 1c – Albedoændringer Forsøg at ændre Albedo af bundens overflade. Det kan fx. gøres ved at lægge et stykke hvidt eller sort papir i bunden. Opstil en hypotese inden du udfører eksperimentet. Diskutér efterfølgende om dine målinger stemmer overens med din oprindelige hypotese. Eksperiment 1d – &Oslahs;get vanddamp TEORI: Ifølge teorien er vanddamp en kraftig drivhusgas. I vores klimasystem fungerer vanddamp i en selvforstærkende mekanisme, idet luft kan indeholde mere vanddamp når det opvarmes. Hvis temperaturen stiger som følge af øget CO2 vil det føre til mere vanddamp i atmosfæren. Da vanddamp i sig selv er en drivhusgas vil dette opvarme atmosfæren yderligere – hvorved der kan indeholdes mere vanddamp osv. OPGAVE: Forsøg at lave et diagram som viser den beskrevne tilbagekobling med de enkelte delprocesser som den indeholder. EKSPERIMENT: Vi vil gerne undersøge denne tilbagekobling eksperimentelt. Derfor tilføjer vi nu et lille vandbad til vores forsøg. Sørg for at der kun er få mm vand i vandbadet (det er nemlig rigeligt). Inden forsøget udføres skal I på baggrund af teorien opstille en hypotese for hvorledes I forventer temperaturen udvikler sig i forhold til referenceeksperimentet. Eksperiment 1e - Andre undersøgelser Find selv på andre undersøgelser. Det kunne fx være at tilføre planter eller ændre styrken af pæren på jeres lampe. HUSK variabelkontrol – altså; man må kun ændre én variabel ad gangen. |
E2 - Demonstration af drivhuseffekt At strålingen fra Solen har nemt ved at passere glas er let at vise, da strålingen fra Solen stort set svarer til bølgelængderne i det synlige område. At man kan se gennem glas viser altså, at Solens stråling ikke absorberes i glas. At glas absorberer varmestråling (stråling med længere bølgelængde end synligt lys) kan demonstreres med følgende lille opstilling: 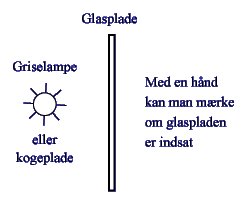 Læs mere i Viden om Vand, www.vand.au.dk/index.php?menu=71 |
E3 – Byg dit eget termometer TEORI: Undersøg hvordan et analogt termometer virker (engelsk: "Bulb thermometer"). Undersøg evt. om der findes en teoretisk grænse for, hvor koldt det kan blive – altså en nedre grænse for temperaturen som begreb. PRAKSIS: Kom en smule farvet vand ned i en flaske. En prop med et hul og et lang glasrør sættes i flasken. Glasrøret skal nå ned i vandet. Varm flasken op ved at holde på den med hænderne. Hvad sker der med vandet? Flere anvisninger til bygning af eget termometer på: home.howstuffworks.com/therm1.htm. |
E4 – Undersøg styrken af en drivhusgas Se Mikkel Rønnes beskrivelse:
|
E5 – Varmeudvidelse af vand Design et forsøg som viser, at vand udvider sig med temperaturen. Diskuter, hvorfor de fleste stoffer udvider sig med temperaturen. |
E6 – Mål forskellige overfladers temperatur Mål forskellige overfladers temperatur udendørs (i solskin!) med et infrarødt termometer. Tag evt. et billede af de overflader, I måler på. Sammenlign klassens målinger. Hvilke forskelle har I fundet? Diskuter i hvilket omfang følgende to udsagn kan forklare jeres målinger: Forskellen i de målte temperaturer skyldes måleusikkerhed i de infrarøde termometre. Forskellen i de målte temperaturer er virkelige og skyldes forskelle i strålingsbalancen eksempelvis i form af mængden af reflekteret lys. |
E7 – Måling af CO2–udvekslingen fra forskellige overflader CO2–udveksling mellem en jordoverflade og atmosfæren kan måles og fx bruges til bestemmelse af fotosyntese eller respiration fra jord og planter. Materialer: Et gennemsigtigt kar og en CO2–måler gerne med elektronisk dataopsamling. Ideelt skal karret monteres med en lille blæser så luften ventileres inden i akvariet. (Dog ikke et krav.)
Forslag til målinger: Placer den gennemsigtige kasse på en græsoverflade. Mål CO2–koncentrationen i solskin i 5–10 min. Kast derefter et klæde over kassen og fortsæt målingerne. Placer nu den gennemsigtige kasse på en overfalde med bar jord. Mål CO2–koncentrationen i solskin i 5–10 min. Kast derefter et klæde over kassen og fortsæt målingerne. Fortsæt evt. med andre relevante overflader. Efterbehandling: Fluxen af CO2 kan beskrives ved følgende formel: hvor Fc er fluxen i μmol/m2 /s, dC/dt er ændringen i CO2–koncentrationen (μmol/mol = ppm) pr. tid (s), V er kammerets volumen (i m3 ), ρ er det aktuelle lufttryk (~1 atm), R er den molare gaskonstant (8,2·10-5 m3 ·atm/(mol·K)), T er temperaturen i Kelvin, og A er overfladearealet i m2 . Beregn fluxen for de forskellige overflader i hhv. sol og skygge. Beregn netto–fluxen af CO2 for de forskellige overflader. Passer det med jeres forventning? Links: Klimaproblematikken og kulstofkredsløbet, Geoviden, nr 2, 2006 fra Geocenter København, Havet afgørende for klimaet, Miljømagasinet 19. januar 2007, www.dr.dk/P1/Miljoemagasinet/Udsendelser/2007/01/18131424.htm |
E8 – Måling af albedo Formål Målet er vha. to forskellige metoder at bestemme albedoværdier for is, jord og vegetation. Albedo (latin for hvid) er andelen af det reflekterede lys. Eksempel: Hvis en overflade tilbagekaster 70% af lyset, siges albedoværdien at være 0,7 eller 70%. Vi vil ved forskellige måder forsøge at måle albedo. Måling af albedo med lysmåler Albedoen for en overflade kan findes ved at måle lysstyrken af det indkomne lys i forhold til lysstyrken af det reflekterede lys. Man kan imidlertid også finde albedoværdien af en overflade ved at sammenligne lysstyrken af det reflekterede lys med en overflade med kendt albedoværdi. Eksempelvis kan man benytte hvidt papir som reference, da man med tilnærmelse kan antage at hvidt papir tilbagekaster næsten alt lyset – dvs. har albedoen 1. Eksempel Du har målt mængden af reflekteret lys fra jord og mængden af reflekteret lys fra hvidt papir. Albedoværdien for jord findes som:
Fremgangsmåde Ved at benytte en lysmåler koblet til en computer skal I måle lysstyrken af det reflekterede lys fra hhv. is, jord, vand og vegetation i forhold til referencen. Gør selv notater vedrørende forsøgets udførelse med henblik på at vurdere metodens brugbarhed.
Måling af albedo med kamera Faktisk måler et fotoapparat jo også reflekteret lys, hvilket vi kan benytte til at finde albedoen af en overflade. Jo mørkere en overflade fremtræder på et billede jo mindre albedo har overfladen. Problemet er blot, at kameraet kan være mere eller mindre lysfølsomt. Vi må derfor som ved den ovenstående metode måle i forhold til en reference. Derfor skal I tage billeder, hvor det udleverede referencekort er med på billedet. Referencekortet kan fx se således ud:
Herefter kan I som beskrevet nedenfor justere billedets lysstyrke og kontrast så referenceværdierne passer i billedet. Gøres dette, kan man direkte aflæse pixelværdien for den undersøgte overflade og finde albedo efter følgende forskrift:
Grunden til at man skal dividere med 255 er, at det svarer til totalreflektion. Dermed ligner formlen den ovenstående. Et eksempel Du har justeret lysstyrke og kontrast på dit billede og derefter aflæst pixelværdien til 50. Herefter findes albedo som:
Fremgangsmåde Ved at benytte et digitalkamera skal I tage billeder af hhv. jord, vegetation, is og vand. Som beskrevet under teorien skal I sørge for at få referencekortet med på billedet. Vha. kablet overføres billederne til computer og nu skal I korrigere lyset og kontrasten på billedet, så værdierne på referencekortet passer. Til dette formål kan I benytte programmet Paint Shop Pro. Korrektion i Paint Shop Pro Først skal billedet lavet om til gråtoner. Dette gøres som vist til højre:
Dernæst kan billedet justeres i menuen vist nedenfor.
Ved hjælp af “dropper”–værktøjet i menuen til venstre kan I aflæse værdien af en pixel.
|
E9 – Mål på kyst– og fastlandsklima Formål Undersøg hvordan Solen opvarmer havområder og landområder forskelligt. Materiale 2 beholdere på samme størrelse, to kraftige lamper (min. 60 W), vand, sand, to termometre – gerne elektroniske med dataopsamling. Fremgangsmåde Hæld nøjagtigt lige meget volumen sand og vand i de to beholdere og sørg for at temperaturen er ens i de to materier, inden I går i gang. Dette kontrolleres! Efterbearbejdning Tegn eksperimentet. |
E10 – Undersøg vinkelafhængigheden af solindstrålingen Formål Vi ved fra dagligdagen at Solen lyser kraftigst, når den er højest på himlen. Målet er at undersøge, hvordan den modtagne mængde solenergi afhænger af indfaldsvinklen? Materialer
Forsøgsbeskrivelse Du skal selv gennemføre målingerne. Se forsøgsopstillingen nedenfor.
Efterbehandling Lave din egen analyse af resultaterne. Brug gerne Excel. Perspektivering Hvilken relevans har forsøget for forståelsen af årstider? Vurder betydningen af jeres resultater i forhold til diskussionen af istider med de såkaldte Milankovitscykler. |
E11 – Hvordan aftager lysintensiteten fra en kilde med afstanden? Formål Målet er at undersøge hvorledes lysintensiteten fra en lyskilde aftager med afstanden. Materialer
Fremgangsmåde Ved hjælp af målebånd og pyranometer skal I måle lysintensiteten (W/m2) i forskellig afstande fra lyskilden. Mål med max.10 cm intervaller den første meter. Herefter kan i godt måle med større intervaller. Pas på lampen bliver varm!
Efterbehandling Efter forsøgets udførelse skal I lave en graf i Excel og forsøge at fitte jeres data med den funktion, som I finder passer bedst. Altså fx en lineær funktion, en potensfunktion eller en eksponentielfunktion. Perspektivering Vurder betydningen af jeres resultater i forhold til diskussionen af istider med de såkaldte Milankovitchcykler. |
E12 – Måling af solindstråling Se Ole Andersens beskrivelse i Viden om Vand, www.vand.au.dk/index.php?menu=23 |
E13 – Den specifikke varmekapacitet for sand, sten og vand Læs om specifik varmekapacitet. Opstil en hypotese for, hvilket af følgende tre materialer der har den største specifikke varmekapacitet: sand, sten og vand. Planlæg og udfør selv eksperimenter, som kan teste jeres hypotese. Hint: Start med at undersøge den specifikke varmekapacitet for vand. Benyt dernæst temperaturstigninger i vand til at måle den specifikke varmekapacitet for sten og sand. Perspektivering: Diskuter ud fra jeres resultater om man bør forvente, at temperaturen stiger lige hurtigt over hhv. hav og land som følge af den globale opvarmning? NB. Man kan gøre øvelsen lettere ved at måle på varmekapacitet i stedet for specifik varmekapacitet. Man skal så blot have sammenlignelige masser. |
E14 – Illustration af ”Grønlandspumpen” Find selv på et forsøg, der illustrerer grønlandspumpen. Det kan være en god ide at benytte frugtfarve til at farve vandet. Du kan på forhånd undersøge densiteten for havvand ved hjælp af nedenstående excel-fil. Undersøgelse af havets lagdeling I det Arktiske Ocean mødes koldt vand med varmere vand, som kommer sydfra. I modsætning til hvad man skulle tro, lægger det varmeste vand sig ikke øverst! Som det kan ses på figuren er temperaturen i overfladen –1,8 °C, mens vandet i 200 m dybde er op mod +2,5 °C. Hvordan kan det være? Svaret ligger i, at densiteten (massefylden) af havvand afhænger af både temperaturen og saltindholdet. Det varmere vand i 200 meters dybde må altså være mere salt. Du kan forsøge at undersøge sammenhængen mellem massefylde, saltindhold og temperatur i Excel-arket du kan downloade her. Her kan du også få svar på, hvordan det kan være, at temperaturen af vandet i overfladen kan være under 0 °C. Forsøg om I kan genskabe en lagdeling med det kolde vand øverst! Farv den vandmasse som er lettest. I kan evt. forsøge forsigtigt at måle temperaturen ned gennem vandsøjlen med et elektronisk termometer (helst en lille termoføler med dataopsamling).
Diskussion
|
E15 – Klimastudier i en danskvand? Formål At undersøge den kemiske ligevægt mellem optaget CO2 i havet i form af kulsyre og indholdet af CO2 i atmosfæren. Materialer Danskvand uden citrus. pH-meter, Teori Start med at diskutere, hvorfor en danskvand bobler? – hvad er det, der bobler op, og hvorfor sker det først, når danskvanden åbnes? Den syre, som vi måler i danskvanden, er kulsyre H2CO3 . Indholdet af CO2 i danskvanden styres af følgende kemiske ligevægt. CO2 (g)+ H2O ↔ H2CO3 (aq) Vi vil i vores analyse af resultaterne kunne postulere, at jo lavere pH-værdi, vi måler, jo mere CO2 er opløst i vandet i form af kulsyre. Omvendt betyder det, at jo tættere pH kommer på neutral, jo mindre CO2 er der tilbage i vandet. Fremgangsmåde Åben to flasker danskvand ved stuetemperatur. Den ene hældes op i to bægerglas. Mens der sættes prop på den anden med det samme igen. Mål straks pH med et pH-meter i de to bægerglas. Opvarm dernæst forsigtigt det ene bægerglas til ca. 50 °C, mens det andet forbliver ved stuetemperatur. Når det ene bægerglas er ca. 50oC aflæses temperaturen og pH måles. Dernæst måles temperatur og pH i det andet bægerglas, som ikke er blevet opvarmet. Til sidst måles temperaturen og pH-værdien i den danskvand som blev lukket igen med det samme. Du skulle nu have tre sæt af temperatur og pH målinger. Diskuter nu Hvad er der sket med CO2–indholdet i vandet i begge bægerglas. Hvad er der sket i danskvanden, som blev lukket igen. Kan vi komme med konklusioner om temperaturens betydning for vands evne til at indeholde CO2? Hvis havene i fremtiden kommer til at indeholde mere CO2 – hvad vil der så ske med pH-værdien? Ekstra En ”spektakulær” måde at vise fænomenet på, er at vælge en pH-indikator som skifter farve lidt under neutral. Så kan man få danskvanden til at skifte farve ved at ryste den. Man kan også benytte en universalindikator. Videre studie Læs artiklen: På vej mod et surt hav af Katherine Richardson og Lone Thybo Mouritsen i Aktuel Naturvidenskab nr. 5. 2006, infolink2003.elbo.dk/Naturvidenskab/dokumenter/doc/8472.pdf. |
E16 – Måling af densitet af havvand Formål At vise hvordan man kan bestemme saltvands densitet. Eventuelt kan man efterfølgende bestemme saltprocenten ud fra sammenhængen mellem densitet og saltprocent, som kan undersøges i dette excelark. Teori Ved et stofs densitet, ρ, forstås forholdet mellem massen, m, og rumfanget, V Forsøgets udførsel I skal fylde lidt saltvand i et måleglas og finde sammenhængen mellem den totale masse, mtotal , og rumfangt, V. Dette skal I gøre mindst 5 gange. Massen måles i g og rumfanget i cm3. Indsæt måledataene i et måle-skema. NB. Gør jer overvejelser over, hvordan I får bestemt rumfanget af vandet så præcist som muligt. Databehandling For massen af måleglasset med saltvand gælder formlen: mtotal = ρ · V + mglas, hvor mglas er massen af måleglasset. Formel kan sammenlignes med ligningen for den rette ligning, y = a · x + b: mtotal = ρ · V + mglas Hvis man indsætter måledataene i et (V, mtotal)–koordinatsystem bør grafen blive en ret linie, hvor densiteten, ρ, er hældningskoefficienten til grafen. I skal derfor først indsætte jeres måledata i Excel og derefter indsætte dem i et (V, mtotal)-koordinatsystem, V på den vandrette akse og mtotal på den lodrette akse. Lad den lodrette akse begynde med 0. Ud fra jeres måledata skal i tegne den bedste rette linie og bestemme hældningskoefficienten.Vis også, hvordan måleglassets masse kan bestemmes ud fra grafen. |
E17 – Bestemmelse af saltindholdet i havvand Modificeret udgave fra vejledning af Lars Bjørn, Vejle Gymnasium, lars.bjoern.person.emu.dk/havvand.htm. Formål At bestemme masseprocenten af salt i havvand ved fire forskellige metoder. En eller flere af metoderne kan evt. udelades. Saltindholdet Saltindholdet angives i masseprocent (masse%), dvs. massen af opløst salt i procent af havvandets samlede masse.
Ved de følgende forsøg skal I bestemme masseprocenten i havvand ved tre forskellige metoder: Vi udfører målingerne på vand fra Vesterhavet og Østersøen. Standarderne (0,5%, 1%, 2%, 3% og 4% salt) er lavet ved at opløse ren natriumchlorid i demineraliseret vand. 1. Bestemmelse af saltindholdet i havvand ved inddampning Metode Vandprøven inddampes, og det inddampede salt vejes. Apparatur Vægt, 250 mL koniske kolber, 25 mL fuldpipette, bunsenbrænder, stativ, kogering og trådnet. Fremgangsmåde Mærk for hver prøve en ren og tør konisk kolbe og vej den præcist (med to decimaler). Indfør kolbens masse i nedenstående skema. Overfør ved hjælp af pipetten 25 mL saltopløsning/havvand til kolben. Vej kolben med indhold og indfør massen af kolbe med indhold i skemaet. Resultater
Behandling af resultaterne Tegn en graf der viser msalt fra de kendte opløsninger som funktion af saltindholdet (bedste rette linie) og find saltindholdet i havvandet ud fra massen af den inddampede rest fra havvandet. 2. Bestemmelse af saltindholdet i havvand ved densitetsbestemmelse Metode Havvandets densitet sammenlignes med densiteten af saltopløsninger med kendt saltindhold. Densiteten af et stof angiver forholdet mellem stoffets masse m og dets volumen V. Eksempel 25 mL saltvand har massen 27,3 g. Densiteten ρ er da: Metode 2 bygger på, at densiteten af saltvand afhænger af saltindholdet. Jo større saltindholdet er, desto større er densiteten. Med andre ord, jo mere saltholdigt, jo tungere er vandet. I de indre danske farvande (Kattegat, Bælthavet, Øresund og vestlige Østersø) vil det mest saltholdige vand lægge sig ved havbunden, mens det mere ferske vand er tættest på overfladen. Apparatur Vægt, 100 mL målekolber. Opløsninger. Vandprøver af havvand, saltopløsninger med 0,5%, 1%, 2%, 3% og 4% salt. Fremgangsmåde
Resultater
Behandling af resultater Tegn en graf, der viser densiteten som funktion af saltprocenten. Aflæs på grafen havvandets saltprocent ved at se, hvilken saltprocent der svarer til den fundne densitet. Er der nogle fejlkilder ved metode 2? 3. Bestemmelse af saltindholdet i havvand ved fældningstitrering Metode Titrering En portion havvand tilsættes en sølvnitratopløsning fra en burette. De tilsatte sølvioner reagerer med chlorid-ionerne. Ved hjælp af en passende indikator kan man se, når alle chloridionerne i saltopløsningen har reageret med sølvionerne. Man aflæser det tilsatte volumen sølvnitrat på buretten. Teori Når man tilsætter sølvnitrat til saltvand, dannes det tungtopløselige sølvchlorid: Ag+ (aq) + Cl–(aq) → AgCl (s)Natriumchloridopløsningen er tilsat en indikator, der indeholder de gule chromationer CrO42– (aq). 2Ag+ (aq) + CrO42–(aq) → Ag2CrO4 (s) Når man kan se en svag blivende rødfarvning ved tilsætning af én dråbe, stoppes titreringen, og volumen af forbrugt sølvnitrat aflæses på buretten. Apparatur 5 mL fuldpipette, burette, stativ med klemme, 250 mL konisk kolbe. Opløsninger: 0,05 M sølvnitrat, 10% kaliumchromatopløsning (indikator), vandprøver af havvand, saltopløsninger med 0,5 %, 1%, 2%, 3 % og 4 % salt. Fremgangsmåde Afpipettér præcis 5 mL saltopløsning/havvand i en 100 mL bægerglas under magnetomrøring. Resultater
Behandling af måleresultater Tegn i et koordinatsystem voluminet af tilsat sølvnitrat (begge målinger) som funktion af saltprocenten og tegn den bedste rette linie gennem punkterne. Find ved hjælp af grafen saltprocenten i havvandet. Er der nogle fejlkilder ved metode 3? Sammenligning af de forskellige metoder Indfør resultatet af hvert forsøg (den fundne masse%) i følgende skema
Diskutér på baggrund af de endelige forsøgsresultater fordele og ulemper ved de forskellige metoder. |
E18 – Frysepunktet for saltvand I denne øvelse undersøges frysepunktet for saltvand eksperimentelt. Hypotese Beskriv hvad du tror, der sker med vands frysepunkt, når man hælder salt i: ___________________________________________________________________________________ ___________________________________________________________________________________ ___________________________________________________________________________________ ___________________________________________________________________________________ Forsøgets udførelse I skal nu udføre forsøget og teste jeres hypotese. Det er vigtigt, at I noterer væsentlige detaljer vedr. forsøget. Selv om det er et simpelt forsøg kan der være detaljer som er væsentlige i forhold til talbehandlingen. Konstruktion af standard saltholdigheder: Jeres gruppe skal konstruere en kendt saltopløsning inden for intervallet 0,5% – 3,5%. Bemærk I skal låne hinandens (de andre gruppers) saltopløsning til jeres målinger. Derfor er det vigtigt, at I er præcise og markerer tydeligt, hvilken saltholdighed I har konstrueret.
I skal nu se på sammenhængen mellem saltindhold og frysepunkt. Tegn i Excel en graf med saltindhold på x–aksen og frysepunktet på y–aksen. Prøv at lave en tendenslinie. Bestemmelse af en ukendt prøve: I får udleveret en ukendt saltopløsning, taget fra et sted i de danske farvande. Mål dens frysepunkt og brug jeres graf til at bestemme dens saltholdighed. I kan finde kort over saltholdigheden i de danske farvande her: ocean.dmi.dk/anim/index.html. Vælg ”saltholdighed, overflade” som parameter i menuen til venstre. Bemærk: Forskere angiver saltholdigheden i ”practical salianity unit” (psu). Med god tilnærmelse kan man antage at 1 psu = 0,1%. DiskussionHer skal i diskutere jeres resultater i forhold til jeres hypoteser. Stemmer resultaterne overens med jeres hypotese? I givet fald hvorfor ikke? På dette sted er det også vigtigt at I vurderer forsøgets metode samt resultater. Konklusion Her skal I kortfattet skrive, hvad I har fundet ud af. Perspektivering Hvilken betydning har jeres eksperiment i den ”virkelige verden”. Har det fx betydning for, hvor der dannes havis? |
E19 – Indfrysning af saltvand Modificeret udgave fra vejledning af Camilla Skytte Vosegaard, Risskov Amtsgymnasium, i Viden om Vand, www.vand.au.dk/index.php?menu=46. Læs om indfrysning af saltvand (engelsk ”Brine rejection”), se fx nsidc.org/seaice/intro.html. Fremgangsmåde Lav 100 mL 3% saltvandsopløsning. Lad eleverne selv finde ud af hvordan. Alternativt hentes vand fra nærmeste hav!
Placer opløsningen i en fryser, indtil cirka halvdelen af opløsningen er frossen. Hæld den flydende fase over i en anden beholder. Mærk de 2 beholdere frossen hhv. ikke–frossen. Lad den frosne opløsning tø op.
Diskussionsspørgsmål Hvilken betydning har denne forskel i koncentration for vores klima? |
E20 – Demonstrationseksperiment, der viser sammenhængen mellem aerosoler og skydannelse Lille demonstrationseksperiment der viser at aerosoler er med til at danne skyer. Materiale En stor glaskolbe ca. 1000 mL Fremgangsmåde Lidt vand hældes i glaskolben, således at bunden bliver dækket. Vent lidt og kør vandet lidt rundt inden næste skridt, således at luften i kolben bliver mættet med vanddamp. Sæt først prop med sprøjte på og prøv at sænke trykket et par gange (hiv op i sprøjten). Se at der ingenting sker. Herefter tændes et par tændstikker, og pustes ud. Hold kolben på skrå, og hold tændstikkerne ind i kolben, således at røgen fra tændstikkerne kommer ind i kolben. Sæt igen proppen på kolben og sprøjten i proppen. Med lidt held (prøv dette et par gange) vil man nu kunne se skydannelse inde i kolben, når man sænker trykket (hiver op i sprøjten). Forsøget skal laves umiddelbart efter at røgen er kommet ned i kolben, idet vandet med tiden vil absorbere aerosolerne i røgen.
Forklaring: Dette lille eksperiment kan bruges til at illustrere aerosolers indflydelse på skydannelsen. Det tager ikke lang tid, og eleverne kan selv lave det. Det illustrerer også ret godt, hvad der sker, når man ser ”mosekonebryg”. Mosekonebryg ses typisk om morgenen i daggryet. Fænomenet skyldes, at den stillestående luft over en mose har højt indhold af aerosoler. Om morgenen bliver de øvre luftlag over mosen varmet op før de nedre, pga. Jordens rotation. Dette bevirker, at luften nede ved mosen vil bevæge sig opad og trykket vil falde. Derfor ses mosekonebryg, på samme vis som i kolben. Paradokset om aerosoler Nye resultater viser, at skyer nær ved Jordens overflade for det meste er med til at køle Jorden. Da aerosoler typisk befinder sig i de nedre lag i atmosfæren, er de altså med til at danne lave skyer, som køler. Af mange sundheds- og miljømæssige årsager har man siden 1990 globalt sænket niveauet af aerosoler. Dette mener mange forskere har været medvirkende årsag til den globale opvarmning. Selvom den totale mængde af aerosoler er nedsat, så er flytrafikken steget eksplosivt i de seneste årtier, hvilket har givet mange aerosoler i de øvre lag af atmosfæren. På grund af det pludselige fald til lavt tryk udenfor motorerne bliver der her dannet skyer, som holder længe, de såkaldte contrails. Disse contrails forstærker drivhuseffekten, og er altså en medspiller i global opvarmning. Spørgsmålet er dog stadig, hvor stor en indflydelse contrails har på den globale opvarmning. Kommentar Forsøget kan laves noget voldsommere, dog ikke af eleverne, ved at danne overtryk i flasken først. Det er forholdsvist simpelt med en cykelpumpe eller lignende og har en slående effekt. En video med eksperimentet kan ses her: www.stevespanglerscience.com/experiment/00000030. Denne version illustrerer også dannelsen af contrails rigtigt godt. |
E21 – Demonstration af konsekvenserne af forsuring i havene Et meget simpelt eksperiment. Put et stykke kridt ned i en mild syre såsom eddike. Forsøget kan let udbygges til at lave en sammenhængende måleserie af pH–værdi – og opløsningshastighed. Brug denne måleserie til at svare på spørgsmålet: Vil et fald af oceanernes pH–værdi på 0,5 fra 8,2 til 7,7 efter jeres mening have konsekvenser for skaldyr i havet? |
E22 – Undersøgelse og brug af klimamodellen – øvelser med modellen E22-1 – Tidsskalaer for temperaturændringer Den store varmekapacitet af havene betyder, at der er en forsinkelse mellem at strålingsbalancen ændrer sig og til at hele klimasystemet har ændret sig tilsvarende. Excel modellen kan bruges til at illustrere dette. Gør følgende: Sæt alle skalafaktorerne på ark 1 til 0 således at der ingen ændring er i strålingsbalancen. Tjek, at strålingsbalancen ser ud som forventet ved at se på grafen under ”samlet strålingsbalance”. Ved ovenstående simuleres en pludselig og voldsom stigning i drivhusgasserne på Jorden. Forslag til arbejdsspørgsmål
E22-2 – De forskellige faktorers indflydelse Prøv en simulering, hvor der kun er taget højde for naturlige svingninger (dvs. ingen ”blandede menneskeskabte drivhusgasser”). Kommentér resultatet. Husk her, at grafernes udgangspunkt er variabelt, dvs. når grafen for modeltemperatur og målt temperatur skal sammenlignes, så er det kun formen på graferne der skal sammenlignes og ikke deres placering på y–aksen. Prøv at undersøge, hvor meget klimaet er afhængigt af de 11-årige perioder i Solens stråling. Dette kan eksempelvist gøres ved at lave en simulering kun ud fra Solens indflydelse på klimaet. Lav en simulering over et scenarium, hvor vi forestiller os, at der blev gennemført en super–Kyoto aftale i 1999, således at man lod det atmosfæriske indhold af drivhusgasser være konstant på 1999 niveau i al fremtid. Hvor meget og hvor længe vil temperaturen alligevel stige fra 1999 og frem? Fremgangsmåde E22-3 – Samme svar af forskellige årsager? I denne øvelse skal I prøve, om I kan lave en god, men fuldstændig urealistisk klimamodel ved at ændre på parametrene, således at modellen passer til observationerne, men mister sin troværdighed. I kan ændre på de forskellige strålingsfaktorers indflydelse (ved at ændre på skaleringen for den enkelte strålingsfaktor, samt parametrene på ark 3 i modellen). Eksempelvis kan man ændre skaleringsfaktoren på menneskeskabte drivhusgasser til 1,3, skaleringsfaktoren på vulkanske aerosoler til 0,3 og temperaturfølsomheden (ark 3) til 0,5 og få en model, der passer godt med temperaturobservationerne, men som ikke er realistisk. Kommentér det faktum, at forskellige kombinationer af de variable giver samme resultat. Hvornår ved man, at man har den ”rigtige” klimamodel? En dansk forskergruppe anført af Henrik Svensmark mener, at Solens aktivitet er den primære årsag til klimaforandringer på Jorden. Efterprøv teorien på vores lille klimasimulator – prøv med forskellige skalafaktorer på Solens variation. En videnskabelig artikel fra juni 2007 modviser den danske forskergruppes resultater, idet argumentet er, at solaktiviteten ikke kan forklare de sidste ca. 20 års temperaturer. Sammenlign dette udsagn med din klimasimulering. Kan man i denne klimamodel også lave en god simulering af temperaturen ved kun at bruge en af de andre faktorer? Kommentér dit resultat. |
E23 – Vær klimaforsker for en dag På siden chooseclimate.org/jcm/jcm4/ (husk at have installeret JAVA) kan man køre en global klimasimulering med forskelligt input fra fx CO2. Man kan også se på IPCCs standardmodeller og gå i detalje med de forskellige output fra en sådan model. Modelleringsprogrammet har en forside der ser således ud:
Programmet er delt i 5 dele. Øverst er der en ”Setup” bjælke, hvor man kan ændre på startbetingelser for modelleringen. Nedenunder denne bjælke er der 4 vinduer med forskellige grafer fra modellen. De to øverste viser nogle af forudsætningerne for modellen. De to nederste nogle af konsekvenserne for Jordens klima. For alle 4 vinduer kan man ændre, hvad der skal plottes. Man kan ændre forudsætningerne for modellen i de to øverste vinduer og se konsekvenserne i de to nederste. Det står beskrevet i vinduet til venstre hver gang man trykker på en knap, hvilke muligheder man har.
|