Hydrogen findes som 3 forskellige isotoper. Det almindelige hydrogenatom har 1 proton i atomkernen, men der findes også hydrogenatomer med både 1 og 2 neutroner i kernen. De tre forskellige hydrogenisotoper skrives således: 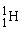 ,
, 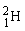 og
og 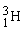 . Det er dog kun de 2 første man finder på Jorden. Den tungere hydrogenisotop,
. Det er dog kun de 2 første man finder på Jorden. Den tungere hydrogenisotop, 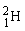 , kaldes også for deuterium med symbolet D.
, kaldes også for deuterium med symbolet D. 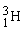 fremstilles ved kernereaktioner.
fremstilles ved kernereaktioner.
Den lette hydrogenisotop, 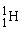 , har en masse på ca. 1 u, mens
, har en masse på ca. 1 u, mens 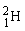 har en masse på ca. 2 u og derfor også kaldes for tungt hydrogen.
har en masse på ca. 2 u og derfor også kaldes for tungt hydrogen.
Normalt vand har den kemiske formel H2O, og indeholder derfor 2 hydrogenatomer. Da et oxygenatom har massen ca. 16 u vil et normalt vandmolekyle, H2O, have molekylmassen 18 u. Hvis begge “normale” hydrogenatomer i et vandmolekyle udskiftes med det tungere D, får man tungt vand, D2O. Da hvert hydrogenatom nu har massen 2 u vil det tunge vandmolekyle, D2O, have massen 20 u.
Ved destillation af vand er det fortrinsvis de lette vandmolekyler, der fordamper først. Derfor kan man fremstille tungt vand ved destillation.
- Hvor mange procent tungere er et tungt vandmolekyle, D2O i forhold til et almindeligt vandmolekyle?
I vand findes også mellemtunge vandmolekyler, HDO. For hver 45 millioner vandmolekyler er der kun ét D2O-molekyle, mens der er over 13 tusind HDO-molekyler.
- Hvor mange procent HDO-molekyler findes der i vand?
Også oxygenatomerne i vandmolekylerne er forskellige, for oxygen har 3 naturligt forekommende isotoper, 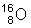 ,
, 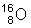 , og
, og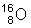 , med forekomster på henholdsvis 99,76%, 0,038% og 0,202%.
, med forekomster på henholdsvis 99,76%, 0,038% og 0,202%.
- Hvor mange forskellige vandmolekyler kan findes i vand?