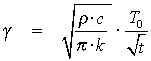Opgave 1
Arbejdsspørgsmål
- Hvor har man fundet H2O-molekyler?
- På hvilken form findes de: fast, flydende eller dampform?
- Hvilke egenskaber ved vandmolekylerne adskiller dem især fra andre lignende molekyler?
Hvorfor er disse egenskaber vigtige?
- Hvor har satellitten ISO fundet vandmolekyler? Brug evt. internetadresserne:
- Fremskaf en kopi af artiklen i Nationalleksikonet for opslagsordet planet.
Besvar på grundlag heraf følgende spørgsmål:
- Hvad er forskellen på en stjerne, en planet og en måne?
- Hvad er nebulaen?
- Forklar den tilhørende figur for din sidekammerat.
- Hvad er grunden til, at flydende vand forekommer så sjældent i Universet?
- Hvad kan splitte vandmolekylet ad?
- Find oplysninger om, hvorfor forskerne i dag søger efter fremmede planeter – og liv. Brug evt. internetadresserne:
|
Opgave 2
Planters tilpasning
Kontinenterne er gennem milliarder af år blevet opbygget og er efterfølgende blevet koloniseret af levende organismer, som via evolution har tilpasset sig særlige levesteder til alt fra varme til kolde klimaer, fra fugtige til tørre egne.
Man taler hos planterne om livsformer, dvs. om bygningstræk, der skyldes tilpasning til særlige miljøer. Et eksempel på dette kunne være planter i ørkenen.
- På hvilken måde adskiller planter i ørkenområder sig fra andre planter?
- Hvilke bygningstræk kan ses som særlige tilpasninger til de livsvilkår der er for planterne i ørkenen?
|
Opgave 3
Hvad betyder farven hos alger?
Fotosyntetiserende organismer benytter klorofyl til at fange fotoner, oplagre deres energi og dermed drive fotosyntesen. Klorofyl er et grønt pigment, der særligt absorberer lys i det røde område. Planter har dog også andre pigmenter, som hjælper med at fange lys med andre bølgelængder.
Hvis man studerer de fastsiddende planter ved klippekyster fra havoverfladen ned mod dybt vand, fordeler de sig i zoner som følge af særlige tilpasninger. Fx skal planter nær overfladen være modstandsdygtige overfor bølgepåvirkning og evt. tolerante overfor periodevis tørlægning ved lavvande.
 |
Fig. 1.
Savtang (Fucus serratus) er en stor læderagtig brunalge, der er et eksempel på en art, der lever nær overfladen og tåler en vis bølgepåvirkning.
|
 |
Fig. 2.
Grønalger nær havoverfladen |
 |
Fig. 3.
Rødalger og en stor brunalge på 25 meters dybde. |
Fra overfladen mod dybere vand sker der ændringer i mængden og kvaliteten af lyset. Dette afspejles i planternes pigmenter. Nær havoverfladen vil hovedparten af planterne være grønne. På dybt vand vil de overvejende være røde, fordi de ud over klorofyl indeholder røde pigmenter.
- Forklar hvorfor planterne dybere nede har et særligt behov for røde pigmenter.
|
Fordampning
Vand anbringes i et termobæger på en elektronisk vægt. I et stativ anbringes en lille dyppekoger, der sænkes helt ned under vandet uden at røre bund og sider. Når vandet koger måles den tilførte elektriske effekt og der laves en tabel over sammenhørende værdier af tid og masse (aflæst på vægten). Udfør selv forsøget.
Resultaterne fra forsøget kunne se således ud:
| Tid/s |
180 |
210 |
240 |
270 |
300 |
330 |
360 |
390 |
420 |
450 |
480 |
510 |
540 |
570 |
| Masse/g |
313 |
306 |
300 |
294 |
287 |
280 |
274 |
267 |
260 |
253 |
247 |
241 |
234 |
228 |
Med et energimeter er den gennemsnitlige tilførte elektriske effekt bestemt til 512 W.
- Foretag en afbildning af de fundne data.
- Brug lineær regression til at finde vandmængden, der fordamper hvert sekund?
- Hvor meget energi tilføres hvert sekund?
- Hvor stor er vands fordampningsvarme?
- Hvad kan være årsagen til, at resultatet afviger fra tabelværdien L = 2.257 kJ/kg.
23% af den indstrålede solenergi bliver brugt til fordampning (når fordampning sker ved 20 °C er vands fordampningsvarme L = 2.454 kJ/kg). Den fordampede vandmængde falder senere som nedbør.
- Hvor meget nedbør (i mm vand) falder der i gennemsnit på Jorden hvert år?
- Sammenlign resultatet med den årlige nedbørsmængde i Danmark.
|
Smeltning
En kendt mængde lunkent vand hældes i termobægeret (vej bægeret med og uden vand). Et par isterninger, der har ligget fremme et stykke tid, aftørres for vand på overfladen og tilsættes det lunkne vand. Sørg for omrøring. Vandets temperatur måles både før tilsætning af isklumperne og efter at al isen er smeltet. Bægeret med vand og smeltet is vejes nu igen. Udfør selv forsøget.
Resultaterne fra forsøget kunne se således ud:
Vands specifikke varmekapacitet er
cv = 4,18 J/(g ·°C)
| Masse, bæger |
mb |
3,87 g |
| Masse, bæger og vand |
mbv
|
217,43 g |
| Masse, vand |
mv |
|
| Temperatur, før is |
tf |
29,6 °C |
| Temperatur, efter is |
te |
11,3 °C |
| Masse, bæger+vand+is |
mb+v+is |
262,39 g |
| Masse, is |
mis |
|
- Find vandets masse, mv.
- Find isens masse, mis.
- Hvor meget energi afgiver det lunkne vand til de tilsatte isklumper?
- Hvor meget energi kræves der for at varme det smeltede is op fra smeltepunktet til sluttemperaturen?
- Hvor meget energi er der brugt til smeltning af isen?
- Hvor stor er isens smeltevarme?
- Sammenlign med tabelværdien på Lis = 334 kJ/kg
- Find ud af hvad man forstår ved kystklima og fastlandsklima
- Gør rede for hvordan granit og vands fysiske egenskaber netop kan give en forklaring på forskellene mellem kyst- og fastlandsklima.
|
|
Opgave 6
Jordens alder
William Thomsen, der senere blev adlet til Lord Kelvin, undersøgte i 1862 Jordens afkølingshistorie. Målinger i dybe brønde og miner viste, at temperaturen stiger med dybden. Temperaturgradienten γ – temperaturstigningen pr. meter – varierede fra sted til sted, men havde et gennemsnit på omkring γ = 0,036 °C/m.
Kelvin antog, at Jorden stille og rolig blev afkølet pga. varmeledning. Han betragtede derfor Jorden som en kugle, der er blevet afkølet fra en ensartet temperatur T0 på det tidspunkt, hvor Jorden blev dannet. Han antog, at begyndelsestemperaturen var 7.000 °F, der kan omregnes til 3.871 °C eller 4.144 K.
Formlen for afkøling af en homogen kugle er
hvor ρ er Jordens middeldensitet (ρ = 5,517 kg/m3), c er Jordens specifikke varmekapacitet (c = 750 J/(kg·K)) og k er den termiske varmeledningsevne (k = 2,52 J/(m·K)). T0 er starttemperaturen i K og t er tiden i s.
- Bestem Jordens alder ud fra dette udtryk – og diskuter, hvorfor det ikke kan være rigtigt.
|
Opgave 7
Aldersbestemmelse af klippematerialer
Den hyppigst benyttede metode er kalium-argon-metoden. Kalium er almindeligt forekommende i bjergarter, hvorimod datterisotopen argon er en ædel luftart, der ikke reagerer med andre stoffer. Kalium er radioaktiv med en halveringstid på 1,25 mia. år, der er en passende værdi set i forhold til Jordens alder.
Det radioaktive 40K udgør kun 0,01167% af kalium i klipper. Det henfalder på to forskellige måder (kC og kA er de tilhørende henfaldskonstanter):
| 1) ved β-henfald |
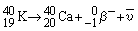 |
kC = 4,96·10-10 år -1 |
| 2) ved elektronindfangning |
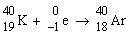 |
kA = 5,81·10-11 år -1 |
- Beregn halveringstiderne for hver af de to processer.
Den samlede henfaldskonstant er summen af henfaldskonstanterne, k = kC + kA
- Beregn halveringstiden for 40K.
Kun ca. 10,5% af den oprindelige kaliummængde henfalder til argon. Da man ikke kender den oprindelige mængde af 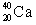 i klipperne, bruges kun henfaldet til argon til aldersbestemmelsen. i klipperne, bruges kun henfaldet til argon til aldersbestemmelsen.
Indholdet af kalium i klippematerialet kan bestemmes kemisk. Antallet af radioaktive kaliumkerner NK er derfor 0,01167% af dette indhold. Argonindholdet bestemmes vha. et massespektrometer efter tilsætning af en kendt mængde 38Ar, hvorved der ved sammenligning kan laves en absolut bestemmelse af antallet NAr af 40Ar kerner.
Den akkumulerede argonmængde i klippematerialet er givet ved
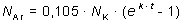
- Ved en prøvetagning i granit måles et argon-kalium forhold på NAr/NK = 0,221. Hvor gammel er granitten?
- Vis formlen (svær opgave).
|
Opgave 8
Energiproduktion i Jordens indre
Granit indeholder et stort antal radioaktive kerner i forhold til basalt. Herved bliver også varmeproduktionen ved radioaktivt henfald op til hundrede gange større i granit.
|
Koncentration ppm (efter vægt)
|
Varmeproduktion 10-11 W/kg
|
| Type |
U |
Th |
K |
U |
Th |
K |
Total |
| Granit |
4,6 |
18 |
33.000 |
43,8 |
46,1 |
11,5 |
101 |
| Kappe |
0,025 |
0,087 |
70 |
0,238 |
0,223 |
0,024 |
0,49 |
Granit har en densitet på ρ = 2,67 ·103 kg/m3, kappens densitet er på ca. ρ = 4,0 · 103 kg/m3.
Antag at Jorden er i termisk ligevægt – dvs. at den energi, der produceres i det indre er lig med den energi, der slipper ud gennem overfladen.
- Beregn effekten fra de radioaktive stoffer, såfremt Jorden udelukkende består af granit.
- Hvor stor bliver effekten pr. m2?
- De samme to spørgsmål, hvis hele Jorden består af materiale som i kappen.
- Sammenlign i begge tilfælde med den faktiske værdi, der er nævnt i heftet.
|
Opgave 9
Energiproduktion ved fotosyntese
I teksten er det nævnt, at Jordens årlige produktion af kulhydrat ved fotosyntese udgør 1016 mol med en brændværdi på 475 kJ/mol.
• Vis, at denne produktion svarer til 0,3 W/m2.
|
Opgave 10
En planets atmosfære afhænger også af planetens størrelse
Jordens atmosfære består fortrinsvis af nitrogen og oxygen. Andre planeter har også atmosfærer, men de består af andre stoffer end på Jorden. Det både regner og sner på andre planeter, men ikke med vand og is.
- Hvad består atmosfæren på Venus af?
- Hvad er det for en sne, der falder på Mars?
Jupiter består fortrinsvis af hydrogen og helium, og på Jupiter er det blandt andet ammoniak, der falder som regn.
Tyngdekraften og temperaturen på en planet er afgørende for hvilken atmosfære, der kan opstå. Store planeter har en større tyngdekraft og kan derfor holde fast i mindre molekyler. På små planeter er tyngdekraften lille og et let molekyle som hydrogen, H2, eller helium, He, kan få så stor fart, at det kan undvige fra planeten og fortsætte videre ud i rummet. Jordens tyngdekraft er for lille til, at den kan holde fast i disse molekyler. Alt helium og alle hydrogenmolekyler vil derfor før eller senere forsvinde fra Jordens atmosfære ud i rummet. De inderste planeter: Merkur, Venus, Jorden og Mars har heller ikke kunnet holde på hydrogen, og de har derfor en oxideret atmosfære af fx CO2 og O2. De større og også koldere planeter som Jupiter, Saturn, Uranus og Neptun har ikke tabt deres hydrogen, og atmosfæren er derfor en reduceret atmosfære bestående af fx H2, NH3 og CH4.
- Find oxidationstallene for O2, H2, CO2, NH3 og CH4.
|
Opgave 11
De forskellige vandmolekyler
Hydrogen findes som 3 forskellige isotoper. Det almindelige hydrogenatom har 1 proton i atomkernen, men der findes også hydrogenatomer med både 1 og 2 neutroner i kernen. De tre forskellige hydrogenisotoper skrives således: 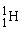 , , 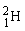 og og 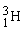 . Det er dog kun de 2 første man finder på Jorden. Den tungere hydrogenisotop, . Det er dog kun de 2 første man finder på Jorden. Den tungere hydrogenisotop, 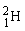 , kaldes også for deuterium med symbolet D. , kaldes også for deuterium med symbolet D. 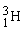 fremstilles ved kernereaktioner. fremstilles ved kernereaktioner.
Den lette hydrogenisotop, 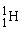 , har en masse på ca. 1 u, mens , har en masse på ca. 1 u, mens 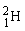 har en masse på ca. 2 u og derfor også kaldes for tungt hydrogen. har en masse på ca. 2 u og derfor også kaldes for tungt hydrogen.
Normalt vand har den kemiske formel H2O, og indeholder derfor 2 hydrogenatomer. Da et oxygenatom har massen ca. 16 u vil et normalt vandmolekyle, H2O, have molekylmassen 18 u. Hvis begge “normale” hydrogenatomer i et vandmolekyle udskiftes med det tungere D, får man tungt vand, D2O. Da hvert hydrogenatom nu har massen 2 u vil det tunge vandmolekyle, D2O, have massen 20 u.
Ved destillation af vand er det fortrinsvis de lette vandmolekyler, der fordamper først. Derfor kan man fremstille tungt vand ved destillation.
- Hvor mange procent tungere er et tungt vandmolekyle, D2O i forhold til et almindeligt vandmolekyle?
I vand findes også mellemtunge vandmolekyler, HDO. For hver 45 millioner vandmolekyler er der kun ét D2O-molekyle, mens der er over 13 tusind HDO-molekyler.
- Hvor mange procent HDO-molekyler findes der i vand?
Også oxygenatomerne i vandmolekylerne er forskellige, for oxygen har 3 naturligt forekommende isotoper, 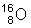 , , 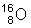 , og , og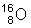 , med forekomster på henholdsvis 99,76%, 0,038% og 0,202%. , med forekomster på henholdsvis 99,76%, 0,038% og 0,202%.
- Hvor mange forskellige vandmolekyler kan findes i vand?
|
|



![]() i klipperne, bruges kun henfaldet til argon til aldersbestemmelsen.
i klipperne, bruges kun henfaldet til argon til aldersbestemmelsen.![]()